
 I. Izomeriya (yunoncha isos - teng) Berzelius, 1830. Izomerlar - bir xil molekulyar formulaga ega (bir xil sifat va miqdoriy tarkibga ega), lekin atomlarning bog'lanish ketma-ketligi va (yoki) fazoda joylashishi bilan farq qiladigan moddalardir. va turli xil xususiyatlarga ega.
I. Izomeriya (yunoncha isos - teng) Berzelius, 1830. Izomerlar - bir xil molekulyar formulaga ega (bir xil sifat va miqdoriy tarkibga ega), lekin atomlarning bog'lanish ketma-ketligi va (yoki) fazoda joylashishi bilan farq qiladigan moddalardir. va turli xil xususiyatlarga ega.
 BERZELIUS, Yons Yakob 1779 - 1848 Mashhur shved kimyogari. 1807 yildan Stokgolmdagi tibbiyot va farmatsiya professori.
BERZELIUS, Yons Yakob 1779 - 1848 Mashhur shved kimyogari. 1807 yildan Stokgolmdagi tibbiyot va farmatsiya professori.
 C 2 H 6 O dimetil efir Bp = -24 C etil spirt Bp = 78 C n-butan Bp = -0,5 C C 4 H 10 izobutan Bp = -11,7 C
C 2 H 6 O dimetil efir Bp = -24 C etil spirt Bp = 78 C n-butan Bp = -0,5 C C 4 H 10 izobutan Bp = -11,7 C
 Alkanlar qatoridagi izomerlar soni Nomi Formula raqami Izomerlar formulasi Nomi Izomerlar soni CH 4 metan 1 C 11 H 24 undekan 159 C 2 H 6 etan 1 C 12 H 26 dodekan 355 C 3 H 8 propan 1 C 13 H 28 tridekan 802 C 4 H 10 butan 2 C 14 H 30 tetradekan 1 858 C 5 H 12 pentan 3 C 15 H 32 pentadekan 4 347 C 6 H 14 geksan 5 C 20 H 42 eikosan C 725 36 797 588 C 8 H 18 oktan 18 C 30 H 62 triakontan 4 111 846 763 C 9 H 20 nonan 35 C 40 H 82 tetrakontan 62 491 178 805 8016 de H 801 8362
Alkanlar qatoridagi izomerlar soni Nomi Formula raqami Izomerlar formulasi Nomi Izomerlar soni CH 4 metan 1 C 11 H 24 undekan 159 C 2 H 6 etan 1 C 12 H 26 dodekan 355 C 3 H 8 propan 1 C 13 H 28 tridekan 802 C 4 H 10 butan 2 C 14 H 30 tetradekan 1 858 C 5 H 12 pentan 3 C 15 H 32 pentadekan 4 347 C 6 H 14 geksan 5 C 20 H 42 eikosan C 725 36 797 588 C 8 H 18 oktan 18 C 30 H 62 triakontan 4 111 846 763 C 9 H 20 nonan 35 C 40 H 82 tetrakontan 62 491 178 805 8016 de H 801 8362
 II. Gomologiya. Uglerod zanjiridagi -CH 2 - guruhlar sonida bir-biridan farq qiluvchi, bir xil funktsional guruhlarga ega bo'lgan bir xil turdagi organik birikmalarning guruhlari gomologik qatorni tashkil qiladi. Metanning gomologik qatori
II. Gomologiya. Uglerod zanjiridagi -CH 2 - guruhlar sonida bir-biridan farq qiluvchi, bir xil funktsional guruhlarga ega bo'lgan bir xil turdagi organik birikmalarning guruhlari gomologik qatorni tashkil qiladi. Metanning gomologik qatori
 III. Izologik seriya. l l Bular bir xil miqdordagi uglerod atomlaridan tuzilgan, lekin H atomlarining miqdoriy tarkibida farq qiluvchi moddalar qatoridir, ya'ni qatorning har bir keyingi a'zosi avvalgisiga qaraganda 2 ta kam H atomini o'z ichiga oladi: C 2 H 6 etan C 2 H 4 etilen C 2 H 2 asetilen
III. Izologik seriya. l l Bular bir xil miqdordagi uglerod atomlaridan tuzilgan, lekin H atomlarining miqdoriy tarkibida farq qiluvchi moddalar qatoridir, ya'ni qatorning har bir keyingi a'zosi avvalgisiga qaraganda 2 ta kam H atomini o'z ichiga oladi: C 2 H 6 etan C 2 H 4 etilen C 2 H 2 asetilen






 Strukturaviy izomeriya 3. Tautomerizm (prototrop yoki dinamik izomeriya) Tautomerizm (yunoncha táōtís - bir xil va mŭros - o'lchovdan) - har biri harakatchan muvozanatda bo'ladigan va bir-biriga o'zgarishi mumkin bo'lgan ikki izomerik shaklning birga yashashi hodisasi.
Strukturaviy izomeriya 3. Tautomerizm (prototrop yoki dinamik izomeriya) Tautomerizm (yunoncha táōtís - bir xil va mŭros - o'lchovdan) - har biri harakatchan muvozanatda bo'ladigan va bir-biriga o'zgarishi mumkin bo'lgan ikki izomerik shaklning birga yashashi hodisasi.







Src="https://present5.com/presentation/73124296_273676330/image-22.jpg" alt="Conformation >C ------- C Conformation >C ------- C
 Geometrik izomeriya Geometrik izomerlar - molekuladagi bog'lanishlarning bir xil tartibiga (ketma-ketligiga) ega, lekin qo'sh bog'lanish tekisligiga yoki kichik halqaga nisbatan kosmosda atomlarning (guruhlarning) joylashishi bilan farqlanadi.
Geometrik izomeriya Geometrik izomerlar - molekuladagi bog'lanishlarning bir xil tartibiga (ketma-ketligiga) ega, lekin qo'sh bog'lanish tekisligiga yoki kichik halqaga nisbatan kosmosda atomlarning (guruhlarning) joylashishi bilan farqlanadi.
Src="https://present5.com/presentation/73124296_273676330/image-24.jpg" alt="Butenning Cis va trans izomerlari-2 Har bir atom >C=C Cis va trans izomerlari buten- 2 Har bir atom >C=C
 Leyt daryosining "bu tomonida va boshqa tomonida" Cisleithania - Avstriya toji erlarining nomi; qizil rangda ko'rsatilgan; 1867 -1918 Transleytaniya - Vengriya tojidagi yerlarning nomi; yashil rangda ko'rsatilgan
Leyt daryosining "bu tomonida va boshqa tomonida" Cisleithania - Avstriya toji erlarining nomi; qizil rangda ko'rsatilgan; 1867 -1918 Transleytaniya - Vengriya tojidagi yerlarning nomi; yashil rangda ko'rsatilgan




 E, Z-nomenklatura 2 1 E-1 -nitro-1 -bromo-2 -xloropenten 1 2 Z-1 -nitro-1 -bromo-2 -xloropenten 1. Kan-Ingold-Prelog qoidalaridan foydalanib, nisbiy ish stajini aniqlang. qo'sh bog' bilan bog'langan o'rinbosarlarning soni va ularga ustunlik tartibida 1 yoki 2 raqamlarini bering.
E, Z-nomenklatura 2 1 E-1 -nitro-1 -bromo-2 -xloropenten 1 2 Z-1 -nitro-1 -bromo-2 -xloropenten 1. Kan-Ingold-Prelog qoidalaridan foydalanib, nisbiy ish stajini aniqlang. qo'sh bog' bilan bog'langan o'rinbosarlarning soni va ularga ustunlik tartibida 1 yoki 2 raqamlarini bering.
 a) Atom raqami yuqori bo'lgan atom kichikroq atomdan kattaroqdir. b) Agar ikkita atom izotop bo'lsa, massa soni kattaroq bo'lgan atom ustunlikka ega. 2. Agar ikkita eng yuqori guruh p-bog'lanish tekisligining bir tomonida joylashgan bo'lsa, u holda o'rinbosarlarning konfiguratsiyasi Z belgisi bilan belgilanadi (nemischa zusammendan birgalikda) Agar bu guruhlar bo'ylab joylashgan bo'lsa. turli tomonlar p-bog'lanish tekisligidan, keyin konfiguratsiya E belgisi bilan belgilanadi (nemischa entgegen qarama-qarshisidan)
a) Atom raqami yuqori bo'lgan atom kichikroq atomdan kattaroqdir. b) Agar ikkita atom izotop bo'lsa, massa soni kattaroq bo'lgan atom ustunlikka ega. 2. Agar ikkita eng yuqori guruh p-bog'lanish tekisligining bir tomonida joylashgan bo'lsa, u holda o'rinbosarlarning konfiguratsiyasi Z belgisi bilan belgilanadi (nemischa zusammendan birgalikda) Agar bu guruhlar bo'ylab joylashgan bo'lsa. turli tomonlar p-bog'lanish tekisligidan, keyin konfiguratsiya E belgisi bilan belgilanadi (nemischa entgegen qarama-qarshisidan)



 Lui Paster (1822 yil 27 dekabr - 1895 yil 28 sentyabr) fransuz kimyogari, 19-asrning eng yirik tadqiqotchisi "Asimmetriya organik dunyoni noorganikdan ajratib turadigan narsadir" (bu qonun stereokimyoga asos solgan). Asimmetrik kristallar qutblangan nurni aylantirish xususiyatiga ega.
Lui Paster (1822 yil 27 dekabr - 1895 yil 28 sentyabr) fransuz kimyogari, 19-asrning eng yirik tadqiqotchisi "Asimmetriya organik dunyoni noorganikdan ajratib turadigan narsadir" (bu qonun stereokimyoga asos solgan). Asimmetrik kristallar qutblangan nurni aylantirish xususiyatiga ega.
 Enantiomerlar fazoviy izomerlar bo'lib, molekulalari ob'ekt va mos kelmaydigan oyna tasviri sifatida bir-biriga bog'langan. (yunoncha enantiosdan - qarama-qarshi).
Enantiomerlar fazoviy izomerlar bo'lib, molekulalari ob'ekt va mos kelmaydigan oyna tasviri sifatida bir-biriga bog'langan. (yunoncha enantiosdan - qarama-qarshi).
 Xirallik (inglizcha chirality, yunoncha chéir - qo'l) - kimyoda ob'ektning ideal tekis oynadagi tasviriga mos kelmasligi xususiyatini tavsiflovchi tushuncha.
Xirallik (inglizcha chirality, yunoncha chéir - qo'l) - kimyoda ob'ektning ideal tekis oynadagi tasviriga mos kelmasligi xususiyatini tavsiflovchi tushuncha.






 Fisher Emil Hermann (9.10.1852, Eiskirchen, – 15.7.1919, Berlin), nemis organik kimyogari va biokimyogari.
Fisher Emil Hermann (9.10.1852, Eiskirchen, – 15.7.1919, Berlin), nemis organik kimyogari va biokimyogari.



 Fisher proyeksiyalarini o'zgartirish mumkin: l l 1. o'rinbosarlarning o'rin almashishlarining juft soni formulani o'zgartirmaydi; 2. o'rinbosarlarning toq sonidagi o'rin almashtirishlari antipod (enantiomer) formulasiga olib keladi; 3. Formulani 90 yoki 270 ga aylantirish, shuningdek formulani ushbu tekislikdan olib tashlash taqiqlanadi (bu harakatlar antipod formulasiga olib keladi); 4. chizma tekisligida butun formulani 180 ga aylantirishga ruxsat beriladi;
Fisher proyeksiyalarini o'zgartirish mumkin: l l 1. o'rinbosarlarning o'rin almashishlarining juft soni formulani o'zgartirmaydi; 2. o'rinbosarlarning toq sonidagi o'rin almashtirishlari antipod (enantiomer) formulasiga olib keladi; 3. Formulani 90 yoki 270 ga aylantirish, shuningdek formulani ushbu tekislikdan olib tashlash taqiqlanadi (bu harakatlar antipod formulasiga olib keladi); 4. chizma tekisligida butun formulani 180 ga aylantirishga ruxsat beriladi;
 Nisbiy konfiguratsiya 1906 yil, M. A. Rozanovning taklifiga ko'ra L- va D-izomerlar (lotincha laevus - chap va dexter - o'ng so'zlaridan).
Nisbiy konfiguratsiya 1906 yil, M. A. Rozanovning taklifiga ko'ra L- va D-izomerlar (lotincha laevus - chap va dexter - o'ng so'zlaridan).



 Kan-Ingold-Prelog tizimi? Robert Sidney Kan Ingold Kristofer Prelog Vladimir (09.06.1899 - 15.09.1981) (28.10.1893 - 10.8.1970) (23.07.1906 - 01.07.1998) (Buyuk Britaniya) (Shveytsariya)
Kan-Ingold-Prelog tizimi? Robert Sidney Kan Ingold Kristofer Prelog Vladimir (09.06.1899 - 15.09.1981) (28.10.1893 - 10.8.1970) (23.07.1906 - 01.07.1998) (Buyuk Britaniya) (Shveytsariya)



 Optik izomerlarning umumiy soni N = 2 n formula bilan aniqlanadi, n - chirallik markazlarining soni. I III IV 2-amino-3-gidroksibutanoik kislota
Optik izomerlarning umumiy soni N = 2 n formula bilan aniqlanadi, n - chirallik markazlarining soni. I III IV 2-amino-3-gidroksibutanoik kislota
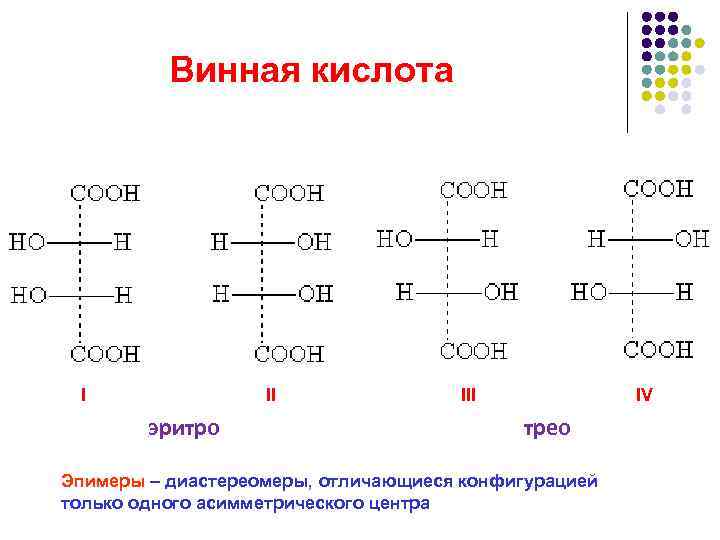 Tatar kislotasi I III IV eritrotreo Epimerlar diastereomerlar bo'lib, ular faqat bitta assimetrik markazning konfiguratsiyasida farqlanadi.
Tatar kislotasi I III IV eritrotreo Epimerlar diastereomerlar bo'lib, ular faqat bitta assimetrik markazning konfiguratsiyasida farqlanadi.

 Racemate (lotincha racemus - uzumdan). D - va L - stereoizomerlarining ekvimolyar miqdori aralashtirilganda optik faol bo'lmagan aralashmalar hosil bo'ladi, ular rasemik S (lotincha sinister - chap) va R (lotincha rectus - o'ng) deb ataladi; Racemat RS belgisi bilan belgilanadi. Rasemik aralashmalarning ajralishi: 1. Mexanik usul (Paster usuli). 2. Mikrobiologik usul 3. Enzimatik usul. 4. Kimyoviy usul. Yaqinlik xromatografiyasi
Racemate (lotincha racemus - uzumdan). D - va L - stereoizomerlarining ekvimolyar miqdori aralashtirilganda optik faol bo'lmagan aralashmalar hosil bo'ladi, ular rasemik S (lotincha sinister - chap) va R (lotincha rectus - o'ng) deb ataladi; Racemat RS belgisi bilan belgilanadi. Rasemik aralashmalarning ajralishi: 1. Mexanik usul (Paster usuli). 2. Mikrobiologik usul 3. Enzimatik usul. 4. Kimyoviy usul. Yaqinlik xromatografiyasi
 STEREOKIMYOVIY TUZILMANINING BIOLOGIK FAOLIYAT KO'RSATIShI BILAN ALOQASI. Adrenalin, epinefrin IUPAC: 1 - (3, 4 - dihidroksifenil) - 2 metilaminoetanol - hayvonlar va odamlarning buyrak usti medullasining gormoni. Vositachi asab tizimi sovuq qonli. Adrenalinning ikkita enantiomeridan R(-) adrenalin eng katta farmakologik faollikni namoyon qiladi.
STEREOKIMYOVIY TUZILMANINING BIOLOGIK FAOLIYAT KO'RSATIShI BILAN ALOQASI. Adrenalin, epinefrin IUPAC: 1 - (3, 4 - dihidroksifenil) - 2 metilaminoetanol - hayvonlar va odamlarning buyrak usti medullasining gormoni. Vositachi asab tizimi sovuq qonli. Adrenalinning ikkita enantiomeridan R(-) adrenalin eng katta farmakologik faollikni namoyon qiladi.

 STEREOKIMYOVIY TUZILMANINING BIOLOGIK FAOLIYAT KO'RSATIShI BILAN ALOQASI. dekstrorotatsion izopropiladrenalin (isadrin) o'zining levorotator enantiomeriga qaraganda 800 marta kuchliroq bronxodilatator ta'sir ko'rsatadi.
STEREOKIMYOVIY TUZILMANINING BIOLOGIK FAOLIYAT KO'RSATIShI BILAN ALOQASI. dekstrorotatsion izopropiladrenalin (isadrin) o'zining levorotator enantiomeriga qaraganda 800 marta kuchliroq bronxodilatator ta'sir ko'rsatadi.

 Diastereomerlar fazoviy izomerlar bo'lib, ularning molekulalari ob'ekt va mos kelmaydigan oyna tasviri sifatida bir-biriga bog'liq EMAS.
Diastereomerlar fazoviy izomerlar bo'lib, ularning molekulalari ob'ekt va mos kelmaydigan oyna tasviri sifatida bir-biriga bog'liq EMAS.

 Konformatsion izomeriya Konformatsion izomeriya bir xil molekula qismlarining bir-biriga nisbatan turlicha joylashishi natijasida yuzaga keladi, bu qismlarni ikki atomni bog'laydigan oddiy C-C bog'i atrofida aylantirish orqali erishiladi.
Konformatsion izomeriya Konformatsion izomeriya bir xil molekula qismlarining bir-biriga nisbatan turlicha joylashishi natijasida yuzaga keladi, bu qismlarni ikki atomni bog'laydigan oddiy C-C bog'i atrofida aylantirish orqali erishiladi.
 (lotincha conformatio — shakl, joylashish), alohida boʻlaklarning atrofida erkin aylanishi natijasida molekulalar tomonidan olingan turli fazoviy shakllar. oddiy C-C ulanishlar.
(lotincha conformatio — shakl, joylashish), alohida boʻlaklarning atrofida erkin aylanishi natijasida molekulalar tomonidan olingan turli fazoviy shakllar. oddiy C-C ulanishlar.







 69% 31% Van der Waals stressi - katta hajmdagi valentlik bilan bog'lanmagan o'rinbosarlar orasidagi itaruvchi kuchlar tufayli yuzaga keladi.
69% 31% Van der Waals stressi - katta hajmdagi valentlik bilan bog'lanmagan o'rinbosarlar orasidagi itaruvchi kuchlar tufayli yuzaga keladi.
Geometrik izomerlar, agar molekuladagi atomlarning erkin aylanishi qo'sh bog' mavjudligi sababli cheklangan bo'lsa, paydo bo'ladi. Bunday juft izomerlarga malein (12,23) va fumarik (12,24) kislotalar (mos ravishda cis- va trans-) misol bo'la oladi.
Geometrik izomerlar kimyoviy tuzilishga juda o'xshash, lekin ular bir-birining oyna tasviri emas va yorug'likning qutblanish tekisligini aylantirmaydi. Qoida tariqasida, cis- va trans-izomerlar fizik xossalari bo'yicha sezilarli darajada farqlanadi. Masalan, malein kislotasi (12,23) 130 ° C da eriydi, uning pKa qiymati 1,9, sovuq suvda juda eriydi (100 ml uchun 79 g); uning geometrik izomeri - fumarik kislotaning (12,24) konstantalari mos ravishda 287 °C, 100 ml uchun 3,0 va 0,7 g. Geometrik izomerlar turli xil biologik xususiyatlarga ega bo'lishi ajablanarli emas va shuning uchun yangi birikmaning kimyoviy formulasini o'rganishda ushbu turdagi izomeriya mavjudligining barcha imkoniyatlarini hisobga olish juda muhimdir.
Cis va trans izomerlarini kristallanish yoki xromatografiya orqali osongina ajratish mumkin. Umumiy usul bir izomerni boshqasiga aylantirishning hech qanday usuli yo'q, lekin qizdirilganda, qoida tariqasida, eng barqaror izomer hosil bo'ladi va yorug'lik ta'sirida kamroq barqaror izomer hosil bo'ladi. Insonning ko'rish qobiliyati yorug'lik ta'sirida retinaning 11-cis izomerining 11-trans shakliga aylanishiga bog'liq. Qiziqarli yorug'lik nurlari yo'qolishi bilanoq,
bu karotinoid pigment yana sis shakliga kiradi va shu bilan miyaga boradigan impulsni to'xtatadi.
Yassi siklopentan halqasida sis- va trans-izomerlar ham mavjud bo'lib, ular katta qo'sh bog'ga o'xshaydi. Siklogeksan halqasi umuman tekis bo'lmasa-da, sis va trans izomerlarini hosil qilish uchun etarlicha tekis. Shunday qilib, diaminosiklogeksanning cis (12.25) va trans (12.26) shakllari mavjud va mavjud. Xuddi shu molekula ham geometrik, ham optik izomerlarni hosil qilishi mumkin. Masalan, trans izomerini (12.26) (S,S) (12.27) va (R,R) (12.28) chiral izomerlarga ajratish mumkin. Biroq, cis izomerini chiral shakllarga bo'lish mumkin emas, chunki u simmetriya tekisligiga ega. Benzol halqasining geometrik izomerlari yo'q, chunki halqaning har bir uglerod atomida faqat bitta o'rinbosar mavjud.
1,2-diaminosinlogensaning stereoizomerlari
Ba'zan cis yoki trans konfiguratsiyasini aniqlash uchun qo'sh bog'dagi to'rtta o'rinbosardan ikkitasini tanlash qiyin bo'lishi mumkin. Ketma-ketlik qoidasiga ko'ra, eng og'ir atomlarga ega bo'lgan o'rinbosarlarni tanlash kerak, cis shakli Z harfi (nemischa zusammen so'zidan) va transformatsiya E (entgegen) harfi bilan belgilanadi. Ba'zan geometrik izomeriya ko'p marta sodir bo'lishi mumkin bo'lgan birikmalar nomlarida eng kichik raqamga ega bo'lgan o'rinbosar (raqamlash qoidasiga ko'ra) g harfi bilan, c-(cis) va t-(trans) belgilari bilan belgilanadi. boshqa o'rinbosarlarning old tomoni janob deputatga nisbatan o'z pozitsiyasini bildiradi.
O'simlik hujayralarining o'sishini rag'batlantiradigan indol-3-ilsetik kislotaga (4.82) o'xshab, boshqa karboksilik kislotalar ham harakat qilishi mumkin, ularning karboksil guruhi aromatik halqa tekisligiga burchak ostida joylashgan. Geometrik izomeriya ikkita o'rinbosarning bunday joylashish imkoniyatini cheklaydi, shuning uchun sinnamik kislotalardan faqat cis izomeri faoldir. 2-feniltsiklopropan-1-karboksilik va 1,2,3,4-tetrahidronaftaliden-1-sirka kislotalarida faqat sis-izomerlar ham faoldir. Molekulyar modellar shuni ko'rsatadiki, bu moddalarning trans-izomeridagi (faol bo'lmagan) halqa va karboksil guruhi bir tekislikda yotadi, sis-shaklda (faol) esa ular koplanar emas. O'rtasidagi bu aloqani birinchi bo'lib ko'rsatdi
Veidstraning mutanosib bo'lmagan va o'sishni rag'batlantiruvchi faoliyati. Non-komplanarlik sterik to'siq tufayli ham paydo bo'lishi mumkin. Shunday qilib, benzoy kislotasi tekis shaklga ega va faol emas, 2,6-diklorbenzoy va 8-metil-1-naftoy kislotalar esa tekis bo'lmagan va biologik faoldir.
Oksin analoglarida karboksil guruhini boshqa elektron tortib oluvchi guruhlar (-CN, -NO 2, -SO3H) bilan almashtirish mumkin, biologik faollik esa bir oz kamayadi. Ushbu turkumdagi tuzilish va harakat o'rtasidagi munosabatlar haqida Koepfli, Thimann, and Went (1938) va Veidstra (1963) ga qarang.
Steroidlarning geometrik izomeriyasi alohida e'tiborga loyiqdir. Formula (12.29) ushbu tabiiy to'yingan birikmalar guruhining umumiy tuzilishini ko'rsatadi (uglerod atomlarining raqamlanishi va to'rtta tsiklning harf belgilari ko'rsatilgan). Tabiiy steroidlarda B va C halqalari trans-birikmada joylashgan bo'lib, ularning ikkalasi ham stul konformatsiyasida bog'langan. Yurak glikozidlarida C va D sikllarining tutashuvi sis konfiguratsiyasiga ega, lekin hayvonlar gormonlari, sterollar va o‘t kislotalarida u trans-birikma hisoblanadi. Ko'pgina biologik faol steroidlarda A va B halqalari trans-birikmada ("5a" seriyasi, ilgari "allo" deb nomlangan). Ukol molekulasidagi halqalarning har biri burmalarni hosil qiladi, bu (12.30) formulaning yon proektsiyasida aniq ko'rinadi.

"5a" belgisi 5-pozitsiyadagi vodorod atomi halqalarning umumiy tekisligi ostida ekanligini ko'rsatadi. Ushbu tekislik ostida joylashgan barcha o'rinbosarlar "a" belgisi bilan, yuqorida esa - "p" belgisi bilan belgilanadi. a- o'rnini bosuvchi nuqta nuqta chiziq bilan, ^- o'rinbosarlari esa qattiq chiziqlar bilan ko'rsatilgan. a- va ^- belgilari boshqa politsiklik birikmalar, masalan, triterpenlar va alkaloidlar uchun ham qo'llaniladi. Ushbu birikmalar strukturasining murakkabligi R- va S-nomenklaturasidan foydalanishni qiyinlashtiradi.
Qoida tariqasida, sutemizuvchilarda steroid birikmalarining yuqori biologik faolligi 1, 9, 11-13, 17-pozitsiyalarda a-o'rinbosarlarning yo'qligi va 4-8, 14, 15-pozitsiyalarda b-o'rinbosarlarning yo'qligi bilan bog'liq. Gidrokortizon molekulasining lateral proyeksiyasi bu qoidani ko'rsatadi. Steroid gormonlarning biologik ta'sirining birinchi bosqichi ularning oqsillarni o'ziga xos transportiga ta'siridir (2.4-bo'lim). Ukol molekulaning tekis pastki tomoni (a-sirt) yordamida oqsillar bilan o'zaro ta'sir qiladi deb taxmin qilinadi.
Turli steroidlar bir-biridan, asosan, R 1, R 2 va R 3 o'rinbosarlarida (12.29), lekin ba'zan to'yinmaganlik darajasida yoki halqalardan tashqarida boshqa o'rinbosarlarning mavjudligida ham farqlanadi. Ukolning progestin, androgen va kortikoid faolligiga ega bo'lishi uchun, qoida tariqasida, A halqasining siklogeksenon tuzilishi mavjudligi, 3, 11 va 17 pozitsiyalarida kislorod atomlari va xarakterli bo'lishi kerak. guruh -CO-CH 2 OH 17-pozitsiyada. Androgen va kortikoid faolligi ko'proq molekula tuzilishining ushbu tafsilotlariga bog'liq, ammo 17-pozitsiyadagi atsetil guruhi a-konfiguratsiyada bo'lsa, progestin faolligi saqlanib qoladi. tabiiy birikmalarda topilmaydi va 18-pozitsiyadagi metil guruhini etil bilan almashtirish hatto bu faollikni kuchaytirishga olib keladi (og'iz orqali kontratseptiv norgestrel).
Barcha steroid gormonlar orasida eng kam qattiq tizimli talablar estrogen faolligi bo'lgan birikmalar tomonidan qo'yiladi. A halqasining aromatizatsiyasi va 3-pozitsiyada kislotali gidroksil guruhi mavjudligini hisobga olgan holda, molekulaning qolgan qismining tuzilishi ikkinchi darajali ahamiyatga ega. 1938 yilda steroidal estrogenlarning oddiy, yuqori samarali benzol analoglari paydo bo'ldi. Ularning molekulalari shakli steroid molekulalariga o'xshash deb hisoblangan bo'lsa-da, aslida ular o'rtasida umumiylik yo'q. X-nurlari diffraktsiya tahliliga ko'ra, dietilstilbestrol molekulasi (12.31) ikki etil guruhining metilen bo'laklari tomonidan yaratilgan sterik to'siq tufayli buzilgan trans konfiguratsiyasiga ega. Shuning uchun, ikkita benzol halqasi etilen bo'lagi bilan 63 ° dihedral burchak hosil qiladi, bu molekula shaklini steroiddan butunlay farq qiladi. Biroq, bu molekulalarda kislorod atomlari orasidagi masofa taxminan bir xil: dietilstilbestrolda 1,21 nm va steroid estrogenlarda 1,07 dan 1,11 nm gacha, ammo bu molekulalarning barchasi juda qattiq va shuning uchun bir xil retseptor bilan o'zaro ta'sir qila olmaydi. qaysi bog'lanish nuqtalari orasidagi masofa belgilangan. Ma'lumki, estrogen faolligining namoyon bo'lishi uchun retseptorning ligandning kislorod atomlari bilan ikkita vodorod aloqasi hosil bo'lishi kerak, shuning uchun retseptor ma'lum bir moslashuvchanlikka ega bo'lishi kerak; Oki, Urushibara (1952) birinchi marta dietilstilbestrolning ta'siri uning molekulasining qalinligi bilan bog'liqligini ta'kidladi, bu 0,45 nm va steroid estrogenlari molekulalarining qalinligiga teng.

Dietilstilbestrol 3,4-di(4-gidroksifenil)heks-3-en
(12.31), asosiy ayol gormoni estradiolining (12.32) samarali va arzon o'rnini bosuvchi 1938 yilda paydo bo'ldi. Bu sintetik dorivor mahsulot, og'iz orqali yuborilganda yuqori samaradorligi va uzoqroq ta'sir qilish muddati bilan tabiiy gormondan farq qiladi, endokrin terapiyada asosiy dori bo'ldi. Ushbu dori-darmonga nisbatan ishonchsizlik ikki omilga asoslanib paydo bo'ldi: birinchidan, qishloq xo'jaligi hayvonlarining vaznini oshirish uchun cheklanmagan holda ishlatilgan, ikkinchidan, homiladorlik paytida onalari qabul qilgan ayollarda saraton holatlari mavjud. Shunga qaramay, dietilstilbestrol keng qo'llanilishi va ko'rib chiqilishida davom etmoqda xavfsiz vositalar; u faqat homiladorlikning dastlabki uch oyida buyurilmaydi (aytmoqchi, bu tabiiy gormonga ham tegishli). Uning fosfatidan prostata saratonini davolashda foydalanish uchun bo'limga qarang. 4.2. Dietilstilbestrol-sinestrolning dihidro hosilasi (12.33, a) (konfiguratsiya 3R, 4S) ham xuddi shunday estrogenik xususiyatlarga ega. U estrogenni bog'laydigan oqsil bilan (2.4-bo'lim) dietilstilbestrolning o'ziga qaraganda kuchliroq bog'lanadi va uning quyi gomologi norxekstrol bu oqsil bilan yanada kuchliroq o'zaro ta'sir qiladi (12.33, b).
Yurak glikozidlari bo'limda muhokama qilinadi. 14.1. Steroidlar kimyosi va stereokimyosi haqida batafsil ma'lumot olish uchun qarang: Shoppee (1964), biokimyo va farmakologiya - Briggs, Christie (1977).
Neyrotransmitter gamma-aminobutirik kislotaning faol konformatsiyasini aniqlashga yordam bergan 4-aminokroton kislotaning geometrik izomeriyasi Sektda muhokama qilinadi. 12.7.
Konfiguratsion izomeriyaga optik va geometrik izomeriya kiradi.
OPTIK IZOMERIZM
1815 yilda J. Biot organik birikmalar uchun optik faollik mavjudligini aniqladi. Ba'zi organik birikmalar qutblangan yorug'likning qutblanish tekisligini aylantirish qobiliyatiga ega ekanligi aniqlandi. Bunday qobiliyatga ega bo'lgan moddalar optik faol deb ataladi.
Agar ma'lumki, elektromagnit tebranishlari turli tekisliklarda tarqalish yo'nalishiga perpendikulyar bo'lgan oddiy yorug'lik nuri Nikol prizmasidan o'tkazilsa, unda paydo bo'ladigan yorug'lik tekis polarizatsiyalangan bo'ladi. elektromagnit tebranishlar faqat bitta tekislikda sodir bo'ladi. Bu tekislik qutblanish tekisligi deyiladi (3.2-rasm).
Qutblangan yorug'lik nuri optik faol moddadan o'tganda, qutblanish tekisligi ma'lum a burchak ostida o'ngga yoki chapga aylanadi. Agar modda qutblanish tekisligini o'ngga og'dirsa (nurga qarab kuzatilganda), u dekstrorotator, agar chapga bo'lsa, chap qo'l deyiladi. O'ngga aylanish (+) belgisi bilan, chapga aylanish (-) belgisi bilan belgilanadi.
Guruch. 3.2. Polarizatsiyalangan yorug'likning hosil bo'lish sxemasi va optik faol moddaning qutblanish tekisligining aylanishi
Optik faollik polarimetrlar deb ataladigan asboblar yordamida o'lchanadi.
Optik faollik hodisasi organik moddalar, ayniqsa tabiiy moddalar (gidroksi va aminokislotalar, oqsillar, uglevodlar, alkaloidlar) orasida keng tarqalgan.
Aksariyat organik birikmalarning optik faolligi ularning tuzilishi bilan belgilanadi.
Organik molekulalarda optik faollikning paydo bo'lishining sabablaridan biri ularning tuzilishida to'rt xil o'rinbosar bilan bog'langan sp 3 - gibridlangan uglerod atomining mavjudligidir. Bunday uglerod atomi chiral yoki assimetrik deyiladi. Ko'pincha buning uchun umumiy nom ishlatiladi - chiral markaz. Strukturaviy formulalarda assimetrik uglerod atomi odatda yulduzcha - C * bilan belgilanadi:

Bitta assimetrik uglerod atomini o'z ichiga olgan birikmalar ikki izomer shaklida mavjud bo'lib, ular bir-biri bilan uning oyna tasviri ob'ekti sifatida bog'langan. Bunday izomerlar deyiladi enantiomerlar.

Guruch. 3.3. Enantiomerik bromoxlorometan molekulalarining modellari
Stereokimyoviy formulalar optik izomerlarning fazoviy tuzilishini tekislikda tasvirlash uchun ishlatilishi mumkin. Masalan, stereokimyoviy formulalar yordamida tasvirlangan 2-butanolning enantiomerlari quyidagicha:

Biroq, stereokimyoviy formulalar molekulalarning fazoviy tuzilishini tavsiflash uchun har doim ham qulay emas. Shuning uchun optik izomerlar ko'pincha Fisher proyeksiya formulalari yordamida tekislikda tasvirlanadi. Masalan, Fisher proyeksiyasi yordamida tasvirlangan 2-bromobutanning enantiomerlari shunday ko'rinishga ega.

Enantiomerlar bir-biriga juda o'xshash, ammo shunga qaramay bir xil emas. Ular molekuladagi atomlarning bir xil tarkibi va bog'lanish ketma-ketligiga ega, lekin kosmosdagi nisbiy joylashuvi, ya'ni konfiguratsiyasi bilan bir-biridan farq qiladi. Ularning modellarini bir-birining ustiga qo'yishga harakat qilganingizda, bu molekulalar boshqacha ekanligini ko'rish oson.
Molekulalarning ko'zgu tasviri bilan birlashtirilmaslik xususiyati xirallik (yunoncha cheir - qo'l) deb ataladi va molekulalar ham chiral deb ataladi. Yaxshi misol - chap va o'ng qo'l qaysilar oyna tasviri bir-biriga, lekin ayni paytda ularni birlashtirib bo'lmaydi. Ko'zgu tasviriga mos keladigan molekulalar axiral deyiladi.
Molekulalarning xiralligi moddaning optik faolligini ko'rsatishi uchun zaruriy shartdir.
Molekulaning chiral ekanligini qanday aniqlash mumkin? Molekulaning xiralligini molekulaning modelini va uning oyna tasvirining modelini qurish va keyin ularni birlashtirish orqali osongina aniqlash mumkin. Agar modellar mos kelmasa, molekula chiral, agar ular mos bo'lsa, molekula axiraldir. Xuddi shu xulosani molekulalarning simmetriya elementlarining mavjudligi va yo'qligiga asoslangan stereokimyoviy formulalari asosida ham chiqarish mumkin, chunki organik birikmalarning optik faolligining sababi ularning assimetrik tuzilishidir. Molekula uch o'lchamli shakllanish bo'lgani uchun uning tuzilishini simmetriya nuqtai nazaridan ko'rib chiqish mumkin. geometrik shakllar. Simmetriyaning asosiy elementlari tekislik, markaz va simmetriya o'qidir. Agar molekulada simmetriya tekisligi bo'lmasa, bunday molekula chiraldir.
Enantiomerlar bir xil fizik va kimyoviy xususiyatlarga ega (qaynoq nuqtasi, erish nuqtasi, eruvchanligi, elektr o'tkazuvchanligi va boshqa doimiylar bir xil bo'ladi), qutblangan nurning polarizatsiya tekisligini bir xil burchak bilan aylantiradi, ammo farqlar ham mavjud.
Enantiomerlar aylanish belgisi bilan farqlanadi, biri polarizatsiyalangan nurning polarizatsiya tekisligini chapga, ikkinchisi o'ngga aylantiradi; ular boshqa chiral birikmalar bilan har xil tezlikda reaksiyaga kirishadi va fiziologik ta'sirda ham farq mavjud. Masalan, levomitsin preparati antibiotik hisoblanadi keng assortiment harakatlar. Agar uning samaradorligi 100 ga teng bo'lsa, dekstrorotatsion shakl chap qo'l shakli samaradorligining atigi 2% ni tashkil qiladi.
Agar molekulada bitta assimetrik atom bo'lsa, u ikkita izomer shaklida mavjud bo'lsa, lekin molekulada bir nechta assimetrik uglerod atomlari bo'lsa, unda mumkin bo'lgan izomerlar soni ortadi. Optik izomerlar soni quyidagi formula bilan aniqlanadi:
bu erda N - izomerlar soni; n - assimetrik uglerod atomlari soni.
Demak, molekulada ikkita assimetrik uglerod atomi bo'lsa, izomerlar soni 2 2 = 4, uchta - 2 3 = 8, to'rtta - 2 4 = 16 va hokazo.
Masalan, ikkita assimetrik uglerod atomini o'z ichiga olgan bromomal kislota to'rtta stereoizomer (I-IV) shaklida mavjud.

Stereomerlar I va II, shuningdek, III va IV, bir-biriga ob'ekt va uning oyna tasviri sifatida tegishli va enantiomerlardir.
Stereoizomerlar 1 va III, 1 va IV, shuningdek, II va HI, H va IV bir-birining oyna tasviri emas, ular assimetrik uglerod atomlaridan birida konfiguratsiyada farqlanadi; Bunday stereoizomerlar diastereomerlar deyiladi. Enantiomerlardan farqli o'laroq, diastereomerlar turli xil fizik va kimyoviy xususiyatlarga ega.
Bir xil o'rinbosarlarga bog'langan ikkita chiral uglerod atomini o'z ichiga olgan birikmalar uchun stereoizomerlarning umumiy soni uchtaga kamayadi. Masalan, tartarik kislota to'rtta stereoizomer (2 2 = 4) shaklida mavjud bo'lishi kerak, ammo faqat uchtasi ma'lum. Bu stereoizomerlardan birida simmetriya tekisligi kabi elementning paydo bo'lishi bilan bog'liq.

Stereomerlar 1 va II enantiomerlardir. Stereoizomer III (mezo shakl) optik jihatdan faol emas. Mezotartar kislota molekulasi axiraldir. Tartar kislotasining har bir enantiomeri mezo shaklga nisbatan diastereomerdir.
Optik izomerlarning nomenklaturasi
Nomenklaturada birikmaning nomi bilan bir qatorda polarizatsiyalangan yorug'lik tekisligining konfiguratsiyasi va aylanish yo'nalishi ham ko'rsatilgan. Ikkinchisi dekstrorotatsion izomer uchun (+) belgisi yoki levorotator izomer uchun (-) belgisi bilan belgilanadi.
Optik izomerlarning konfiguratsiyasini ko'rsatish uchun D, L- va mavjud R, S-stereokimyoviy tizimlar.
D, L konfiguratsiyani belgilash tizimi. Molekulalarning mutlaq konfiguratsiyasini o'rnatish kimyogarlar uchun juda qiyin vazifa ekanligi isbotlangan. Bunga birinchi marta 1951 yilda rentgen nurlari diffraktsiyasi tahlili yordamida erishilgan. Shu vaqtgacha optik izomerlarning konfiguratsiyasi maxsus tanlangan standart modda bilan taqqoslash yo'li bilan o'rnatildi. Ushbu konfiguratsiya nisbiy deb ataladi. 1906 yilda rus olimi M.A. Rozanov nisbiy konfiguratsiyani o'rnatish uchun standart sifatida glitseraldegidni taklif qildi,

Dekstrorotatsion izomer uchun biz Fisher formulasini tanladik, unda chiral uglerod atomidagi gidroksil guruhi o'ngda, chap qo'l izomeri uchun esa chap tomonda. Dekstrorotatsion izomerning konfiguratsiyasi D harfi bilan, chap qo'l izomeri esa L bilan belgilanadi.
Taqqoslash standarti sifatida glitseraldegiddan foydalanib, chiral birikmalarning stereokimyoviy tasnifi uchun D, L-tizimi ishlab chiqildi, ya'ni mos ravishda D- yoki L-stereokimyoviy qatorlarga birikmalar tayinlandi.
D, L tizimi asosan ko'p atomli spirtlar, gidroksi-, aminokislotalar va uglevodlar qatorida qo'llaniladi:

a-piroksi kislotalar, a-aminokislotalar, tartarik kislotalar kabi bir nechta assimetrik uglerod atomlari bo'lgan birikmalar uchun konfiguratsiya shartli ravishda yuqori assimetrik uglerod atomi (gidroksil kislota kalitiga ko'ra) bilan belgilanadi, uglevod molekulasida esa konfiguratsiya. pastki assimetrik uglerod atomi tomonidan (an'anaviy ravishda) aniqlanadi.

R,S konfiguratsiyani belgilash tizimi. D, L- tizim glitseraldegidga ozgina o'xshash bo'lgan birikmalar uchun amalda nomaqbul bo'lib chiqdi. Shuning uchun R ni Kan, K. Ingold va V. Prelog taklif qilgan R, S- optik izomerlarning mutlaq konfiguratsiyasini belgilash tizimi. R, S- Tizim xiral markazdagi o'rinbosarlarning stajini aniqlashga asoslangan.
O'rinbosarlarning kattaligi elementlarning atom raqamlari bilan belgilanadi. Atom raqami qanchalik katta bo'lsa, o'rnini bosuvchi kattaroq bo'ladi. Masalan, bromoiodoxlorometan molekulasida o'rinbosarlarning yoshi ketma-ketlikda kamayadi:

O'rinbosarlarning yoshi aniqlangandan so'ng, model molekulasi eng past atom raqamiga ega bo'lgan o'rinbosar kuzatuvchining ko'ziga qarama-qarshi yo'nalishda yo'naltiriladi. Agar qolgan uchta o'rinbosarning yoshi soat yo'nalishi bo'yicha kamaysa, u holda molekula R harfi bilan belgilangan konfiguratsiyaga ega (lot., rectus - o'ng), va agar o'rinbosarlarning yoshi soat miliga teskari bo'lsa, konfiguratsiya S harfi bilan belgilanadi ( lat. sinster - chap). Masalan, bromoiodoxlorometan molekulasi uchun:

3.4-rasm. Bromoiodoxlorometan molekulasi uchun R,S tizimi yordamida konfiguratsiyani aniqlash
Sut kislotasi misolida o'rinbosarlarning yoshi va murakkabroq molekulalar uchun konfiguratsiyani aniqlashni ko'rib chiqamiz (3.4-rasm). Birinchi qatlamdan allaqachon (8 O, b C, 1 H, 6 C) katta o'rinbosar OH guruhi, kichik o'rinbosar esa vodorod ekanligi ayon bo'ladi. Birinchi qatlamda bir xil atom raqami (6 C) bo'lgan boshqa ikkita o'rinbosar CH^ va COOH ning kattaligini aniqlash uchun ikkinchi qatlamni hisobga olish kerak. CH 3 guruhining ikkinchi qatlamining atom raqamlari yig'indisi = 1 + 1 + 1 = 3 va COOH guruhi = 8 + 8 * 2 = 24. Bu COOH guruhini bildiradi. eski guruh–CH 3 Sut kislotasi molekulasidagi assimetrik uglerod atomi atrofidagi o‘rinbosarlarning yoshi quyidagi tartibda kamayadi: OH > COOH > CH 3 > H.


Guruch. 3.5. Sut kislotasi uchun R,S tizimi yordamida konfiguratsiyani aniqlash
Poygadoshlar. Teng miqdorda enantiomerlar aralashmasi optik jihatdan faol emas va rasemik aralashma (rasemat) deb ataladi. Racematlar jismoniy xossalari bo'yicha individual enantiomerlardan farq qiladi, ular turli erish nuqtalari va eruvchanligiga ega bo'lishi mumkin; spektral xarakteristikalari bilan farqlanadi.
Amalda ko'pincha individual enantiomerlar emas, balki xiral molekulalarning hosil bo'lishi bilan sodir bo'ladigan kimyoviy reaktsiyalar natijasida hosil bo'lgan rasematlarga duch keladi.
Rasematlarni enantiomerlarga ajratish uchun uchta usul qo'llaniladi:
1. Mexanik usul. Ba'zi optik faol birikmalarning kristallanishi natijasida ob'ekt va uning oyna tasviri sifatida bir-biriga o'xshash kristallarning ikkita shakli hosil bo'lishi mumkin. Ularni mikroskop ostida preparativ igna bilan ajratish mumkin (mexanik).
2. Biokimyoviy usul mikroorganizmlarning ayrim turlarining enantiomerik shakllardan birini afzal ko'rishi va uni iste'mol qilishi, ikkinchisi qolishi va oson ajratilishiga asoslanadi.
3. Kimyoviy usul enantiomerlarni optik faol reagentlar yordamida allaqachon bir-biridan fizik xossalari bilan farq qiladigan di-stereomerlarga aylantirishga asoslangan. Diastereomerlarni ajratish ancha oson.
Masalan, ikkita kislotaning rasemik aralashmasini (A + B) ajratish kerak, buning uchun aralashmaga optik faol asos (C) qo'shiladi. Rasemik shakl va optik faol asos o'rtasida reaktsiya sodir bo'ladi
AC va BC diastereomerlardir. Ular turli xil eruvchanlikka ega va ketma-ket kristallanish orqali ikkita diastereomerni alohida ajratib olish mumkin.
Ammo AC va BC kuchsiz organik kislotalar va asoslardan hosil bo'lganligi sababli, ularni parchalash uchun mineral kislotalar ishlatiladi.

Shu tarzda sof A va B enantiomerlari olinadi.
GEOMETRIK IZMERIZM
Geometrik izomeriyaning paydo bo'lishining sababi s bog'lanish atrofida erkin aylanishning yo'qligi. Izomeriyaning bu turi qo'sh bog'li birikmalar va alitsiklik birikmalarga xosdir.
Geometrik izomerlar - molekulyar formulalari bir xil, molekulalardagi atomlarning bir xil bog'lanish ketma-ketligiga ega bo'lgan, lekin qo'sh bog'lanish tekisligiga yoki halqa tekisligiga nisbatan kosmosda atomlar yoki atom guruhlarining turlicha joylashishi bilan bir-biridan farq qiladigan moddalar.
Ushbu turdagi izomeriyaning paydo bo'lishining sababi tsiklni tashkil etuvchi qo'sh bog' yoki s-bog'lar atrofida erkin aylanishning mumkin emasligidir.
Masalan, buten-2'CH3 –CH=CH-CH3 2 izomer shaklida bo'lishi mumkin, ular qo'sh bog'lanish tekisligiga nisbatan kosmosda metil guruhlarining joylashishi bilan farqlanadi.

yoki 1,2-dimetilsiklopropan ikkita izomer shaklida mavjud bo'lib, ular halqa tekisligiga nisbatan kosmosda metil guruhlarini joylashtirishda farqlanadi:

Geometrik izomerlarning konfiguratsiyasini belgilash uchun cis-, trans-tizim ishlatiladi. Agar bir xil o'rinbosarlar qo'sh bog'lanish yoki halqa tekisligining bir tomonida joylashgan bo'lsa, konfiguratsiya cis- bilan belgilanadi. qarama-qarshi tomonlarda bo'lsa - trans-.
Qo'sh bog'langan uglerod atomlarida turli o'rinbosarlarga ega bo'lgan birikmalar uchun Z, E belgilar tizimi qo'llaniladi.
Z, E tizimi umumiyroqdir. Bu har qanday o'rinbosar to'plamiga ega geometrik izomerlarga nisbatan qo'llaniladi. Ushbu tizim har bir uglerod atomi uchun alohida belgilanadigan o'rinbosarlarning yoshiga asoslanadi. Har bir juftlikdan katta o'rinbosarlar qo'sh bog'ning bir tomonida joylashgan bo'lsa, konfiguratsiya Z harfi bilan belgilanadi (nemis tilidan zusammen - birga), agar qarama-qarshi tomonlarda - £ harfi bilan (nemischa entgegen - qarama-qarshi).
Shunday qilib, 1-bromo-1-xloropropen uchun ikkita izomer mumkin:

Bitta uglerod atomidagi katta o'rinbosar metil guruhidir (1 H va 6 CH 3 o'rnini bosuvchi). ikkinchisi esa brom atomiga ega (o'rinbosarlari 17 Cl va 35 Br). 1-izomerda katta o'rinbosarlar qo'sh bog'lanish tekisligining bir tomonida joylashgan;
Geometrik izomerlar har xil jismoniy xususiyatlar(erish va qaynash haroratlari, eruvchanligi va boshqalar), spektral xarakteristikalar va kimyoviy xossalar. Xususiyatlardagi bu farq fizik va kimyoviy usullar yordamida ularning konfiguratsiyasini o'rnatishni juda oson qiladi.
Izomerlar, izomeriya
Izomerlar- bular bir xil sifat va miqdoriy tarkibga ega, ammo tuzilishi har xil va shuning uchun har xil xususiyatlarga ega bo'lgan moddalardir.
Izomerlarning mavjudligi hodisasi deyiladi izomerizm
Masalan, C 4 H 10 tarkibiga ega bo'lgan moddada ikkita izomerik birikma mavjud.
Butan va izobutanning fizik xususiyatlari har xil: izobutan ko'proq past haroratlar n.butanga qaraganda erish va qaynatish.
Butan molekulasining shar va tayoq modeli Izobutan molekulasining shar va tayoq modeli
Bu izomerlarning kimyoviy xossalari bir oz farq qiladi, chunki ular bir xil sifat tarkibiga va molekuladagi atomlar orasidagi bog'lanish xarakteriga ega.
Izomerlarning yana bir ta'rifi quyidagicha berilishi mumkin:
Izomerlar - bir xil molekulyar, ammo tuzilish formulalari har xil bo'lgan moddalar.
Izomeriya turlari
Izomerlarning tuzilishidagi farqlarning tabiatiga qarab, mavjud tizimli Va fazoviy izomerizm.
Strukturaviy izomerlar- bir xil sifat va miqdoriy tarkibga ega bo'lgan, atomlarning bog'lanish tartibi, ya'ni kimyoviy tuzilishi bilan farq qiluvchi birikmalar..
|
Strukturaviy izomeriya quyidagilarga bo'linadi: |
||
|
1.Uglerod skeletining izomeriyasi |
2.Pozitsion izomeriya (bir nechta bog'lanish, funktsional guruh, o'rinbosar) |
3.Sinflararo izomeriya CH 3 -CH 2 -NO 2 nitroetan HOOC-CH 2 -NH 2 aminoasetik kislota (glisin) |
|
Pozitsiya izomeriyasi |
||
|
bir nechta ulanish CH 2 = CH-CH = CH 2 CH 3 -CH= C= CH 2 |
funktsional guruh CH 3 -CHON -CH 3 CH 2 OH -CH 2 -CH 3 |
o'rinbosari CH 3 -CHCI -CH 3 CH 2 CI -CH 2 -CH 3 |
Strukturaviy izomeriya
|
|
Ko'p (juft) bog'lanish pozitsiyasining izomeriyasi: Buten-1 va buten-2 |
|
Uglerod skeleti izomeriyasi: Siklobutan va metilsiklopropan |
|
|
Sinflararo izomeriya: Buten va siklobutan |
Fazoviy izomerlar (stereoizomerlar) bir xil tarkibga va bir xil kimyoviy tuzilishga ega bo'lib, ular molekuladagi atomlarning fazoviy joylashuvida farqlanadi.
|
Fazoviy izomeriya quyidagilarga bo'linadi: |
|
|
|
Qo'sh bog'lanish yoki tsiklik bo'lgan moddalarning xarakteristikasi. |
Optik izomerlar oyna yoki chiral deb ham ataladi (chap va o'ng qo'l kabi)
1. Strukturaviy izomeriya.
2. Konformatsion izomeriya.
3. Geometrik izomeriya.
4. Optik izomeriya.
Izomerlar- bular tarkibi va molekulyar og'irligi bir xil, ammo fizik va kimyoviy xossalari har xil bo'lgan moddalardir. Izomerlarning xossalaridagi farqlar ularning kimyoviy yoki fazoviy tuzilishidagi farqlarga bog‘liq. Shu munosabat bilan izomeriyaning ikki turi ajratiladi.
izomerizm
tizimli
fazoviy
uglerod skeleti
Konfiguratsiya
Konformatsion
Funktsional pozitsiya
Optik
Sinflararo
Geometrik
1. Strukturaviy izomeriya
Strukturaviy izomerlar kimyoviy tuzilishda farqlanadi, ya'ni. molekuladagi atomlar orasidagi bog'lanishlarning tabiati va ketma-ketligi. Strukturaviy izomerlar sof shaklda ajratiladi. Ular individual, barqaror moddalar sifatida mavjud bo'lib, ularning o'zaro o'zgarishi yuqori energiyani talab qiladi - taxminan 350 - 400 kJ / mol. Faqat strukturaviy izomerlar - tautomerlar dinamik muvozanatda bo'ladi. Tautomeriya organik kimyoda keng tarqalgan hodisadir. Bu harakatlanuvchi vodorod atomining molekulada (karbonil birikmalari, aminlar, geterotsikllar va boshqalar) o'tkazilishi, molekula ichidagi o'zaro ta'sirlar (uglevodlar) orqali mumkin.
Barcha strukturaviy izomerlar strukturaviy formulalar shaklida taqdim etiladi va IUPAC nomenklaturasiga muvofiq nomlanadi. Masalan, C 4 H 8 O tarkibi strukturaviy izomerlarga mos keladi:
A)turli uglerod skeletlari bilan
tarmoqlanmagan S zanjiri - CH 3 -CH 2 -CH 2 -CH=O (butanal, aldegid) va
tarvaqaylab ketgan C zanjiri -
 (2-metilpropanal, aldegid) yoki
(2-metilpropanal, aldegid) yoki
tsikl -  (siklobutanol, siklik spirt);
(siklobutanol, siklik spirt);
b)funktsional guruhning turli pozitsiyasi bilan
 butanon-2, keton;
butanon-2, keton;
V)funktsional guruhning turli tarkibi bilan
 3-butenol-2, to'yinmagan spirt;
3-butenol-2, to'yinmagan spirt;
G)metamerizm
Geteroatom funktsional guruhi uglerod skeletiga (tsikl yoki zanjir) kiritilishi mumkin. Ushbu turdagi izomeriyaning mumkin bo'lgan izomerlaridan biri CH 3 -O-CH 2 -CH=CH 2 (3-metoksipropen-1, efir);
d)tautomerizm (keto-enol)
enol shakli  keto shakli
keto shakli
Tautomerlar dinamik muvozanatda bo'lib, aralashmada barqarorroq shakldagi keto formasi ustunlik qiladi.
Aromatik birikmalar uchun strukturaviy izomeriya faqat yon zanjir uchun hisobga olinadi.
2. Fazoviy izomeriya (stereoizomeriya)
Fazoviy izomerlar bir xil kimyoviy tuzilishga ega va molekuladagi atomlarning fazoviy joylashuvida farqlanadi. Bu farq fizik va kimyoviy xossalardagi farqni keltirib chiqaradi. Fazoviy izomerlar turli proyeksiyalar yoki stereokimyoviy formulalar shaklida tasvirlangan. Kimyoning fazoviy tuzilishi va uning birikmalarning fizik-kimyoviy xossalariga, reaksiyalarining yoʻnalishi va tezligiga taʼsirini oʻrganadigan boʻlimi stereokimyo deb ataladi.
A)Konformatsion (aylanma) izomeriya
Bog'lanish burchaklarini ham, bog'lanish uzunligini ham o'zgartirmasdan, molekulaning ko'plab geometrik shakllarini (konformatsiyalarini) tasavvur qilish mumkin, ular bir-biridan uglerod tetraedralarining ularni bog'laydigan s-C-C bog'i atrofida o'zaro aylanishida farqlanadi. Bunday aylanish natijasida aylanuvchi izomerlar (konformerlar) paydo bo'ladi. Turli konformatorlarning energiyasi bir xil emas, lekin turli konformatsion izomerlarni ajratuvchi energiya to'sig'i ko'pchilik organik birikmalar uchun kichikdir. Shuning uchun oddiy sharoitda, qoida tariqasida, molekulalarni bitta qat'iy belgilangan konformatsiyada mahkamlash mumkin emas. Odatda, bir nechta konformatsion izomerlar osongina bir-biriga aylanadi, muvozanatda birga yashaydi.
Izomerlarni tasvirlash usullari va nomenklaturasini etan molekulasi misolida ko'rib chiqish mumkin. Buning uchun biz energiya jihatidan maksimal darajada farq qiladigan ikkita konformatsiya mavjudligini oldindan ko'rishimiz mumkin, ularni shaklda tasvirlash mumkin. istiqbolli prognozlar(1) ("arra tegirmon echkilari") yoki prognozlar Nyuman(2):

inhibe qilingan konformatsiya tutilgan konformatsiya
Perspektiv proyeksiyada (1) C-C aloqasi masofaga borishni tasavvur qilish kerak; Chapdagi uglerod atomi kuzatuvchiga yaqin, o'ngdagi uglerod atomi esa undan uzoqroq.
Nyuman proyeksiyasida (2) molekula birga qaraladi S-S ulanishlari. Doira markazidan 120 ° burchak ostida ajralib chiqadigan uchta chiziq kuzatuvchiga eng yaqin bo'lgan uglerod atomining aloqalarini ko'rsatadi; aylana orqasidan "tashqariga chiqadigan" chiziqlar uzoqdagi uglerod atomining aloqalaridir.
O'ng tomonda ko'rsatilgan konformatsiya deyiladi xiralashgan . Bu nom ikkala CH 3 guruhining vodorod atomlari bir-biriga qarama-qarshi ekanligini eslatib turadi. Tutilgan konformatsiya ichki energiyani oshirdi va shuning uchun noqulay. Chapda ko'rsatilgan konformatsiya deyiladi inhibe qilingan , CC aloqasi atrofida erkin aylanish bu holatda "inhibe qilingan" degan ma'noni anglatadi, ya'ni. molekula asosan bu konformatsiyada mavjud.
Molekulani ma'lum bir bog'ning atrofida to'liq aylantirish uchun zarur bo'lgan minimal energiya bu bog'ning aylanish to'sig'i deb ataladi. Etan kabi molekuladagi aylanish to'sig'ini o'zgarish bilan ifodalash mumkin potentsial energiya molekulalar tizimning dihedral (burilish - t) burchagidagi o'zgarishlar funktsiyasi sifatida. Etandagi C-C aloqasi atrofida aylanishning energiya profili 1-rasmda ko'rsatilgan. Etanning ikki shaklini ajratib turuvchi aylanish to'sig'i taxminan 3 kkal/mol (12,6 kJ/mol). Potensial energiya egri chizig'ining minimallari inhibe qilingan konformatsiyalarga, maksimallari esa yopilgan konformatsiyalarga mos keladi. Xona haroratida ba'zi molekulyar to'qnashuvlar energiyasi 20 kkal / mol (taxminan 80 kJ / mol) ga yetishi mumkinligi sababli, bu 12,6 kJ / mol to'siqni osongina engib o'tish mumkin va etanda aylanish erkin hisoblanadi.

Barcha mumkin bo'lgan konformatsiyalar aralashmasida inhibe qilingan konformatsiyalar ustunlik qiladi.
1-rasm. Etan konformatsiyalarining potentsial energiya diagrammasi. Keyinchalik murakkab molekulalar uchun mumkin bo'lgan konformatsiyalar soni ortadi. Ha, uchun n

-butanni allaqachon markaziy C 2 - C 3 aloqasi atrofida aylanayotganda paydo bo'ladigan va CH 3 guruhlarining o'zaro joylashishida farq qiladigan oltita konformatsiyada tasvirlash mumkin. Butanning turli tutilgan va inhibe qilingan konformatsiyalari energiya jihatidan farq qiladi. Inhibe qilingan konformatsiyalar energetik jihatdan qulayroqdir.

Butandagi C 2 -C 3 bog'i atrofida aylanishning energiya profili 2-rasmda ko'rsatilgan.
2-rasm. n-butan konformatsiyalarining potentsial energiya diagrammasi.
Alitsiklik birikmalar molekulasi tsiklning turli konformatsion shakllari bilan tavsiflanadi (masalan, siklogeksan uchun). kreslo, hammom, burish-shakllar).
Shunday qilib, konformatsiyalar ma'lum bir konfiguratsiyaga ega bo'lgan molekulaning turli fazoviy shakllaridir. Konformerlar - potentsial energiya diagrammasidagi energiya minimallariga mos keladigan, harakatchan muvozanatda bo'lgan va oddiy s bog'lanishlar atrofida aylanish orqali o'zaro konvertatsiya qilish qobiliyatiga ega stereoizomerik tuzilmalar.
Agar bunday transformatsiyalar uchun to'siq etarlicha yuqori bo'lsa, unda stereoizomerik shakllarni ajratish mumkin (masalan, optik faol bifenillar). Bunday hollarda biz endi konformerlar haqida emas, balki aslida mavjud stereoizomerlar haqida gapiramiz.
b)Geometrik izomeriya
Geometrik izomerlar molekulada quyidagilar yo'qligi natijasida paydo bo'ladi:
1. uglerod atomlarining bir-biriga nisbatan aylanishi C=C qo‘sh bog‘lanish yoki siklik strukturaning qattiqligining oqibati;
2. qo'sh bog' yoki halqaning bir uglerod atomida ikkita bir xil guruh.
Geometrik izomerlar, konformerlardan farqli o'laroq, sof shaklda ajratilishi va individual, barqaror moddalar sifatida mavjud bo'lishi mumkin. Ularning o'zaro o'zgarishi uchun yuqori energiya talab qilinadi - taxminan 125-170 kJ / mol (30-40 kkal / mol).
Cis-trans-(Z,E) izomerlari mavjud; cis- shakllar geometrik izomerlar bo'lib, ularda bir xil o'rinbosarlar p bog'lanish yoki halqa tekisligining bir tomonida joylashgan; trans - shakllar geometrik izomerlar bo'lib, ularda bir xil o'rinbosarlar p bog'i yoki halqa tekisligining qarama-qarshi tomonlarida yotadi.
Eng oddiy misol buten-2 izomerlari bo'lib, ular sis-, trans-geometrik izomerlar shaklida mavjud:


sis-buten-2 trans-buten-2
erish nuqtasi
138,9 0 S - 105,6 0 S
qaynash nuqtasi
3,72 0 S 1,00 0 S
zichligi
1,2 - diklorotsiklopropan sis-, trans-izomerlar shaklida mavjud:


sis-1,2-diklorotsiklopropan trans-1,2-diklorotsiklopropan
Keyinchalik murakkab holatlarda u qo'llaniladi Z,E-nomenklatura (Kanna, Ingold, Prelog nomenklaturasi - KIP, deputatlar stajining nomenklaturasi). Aloqada
1-bromo-2-metil-1-xlorobuten-1 (Br)(CI)C=C(CH 3) - CH 2 -CH 3 qo'sh bog'langan uglerod atomlaridagi barcha o'rinbosarlar har xil; shuning uchun bu birikma Z-, E- geometrik izomerlar shaklida mavjud:


E-1-bromo-2-metil-1-xlorobuten-1 Z-1-bromo-2-metil-1-xlorobuten-1.
Izomer konfiguratsiyasini ko'rsatish uchun ko'rsating katta o'rinbosarlarning qo'sh bog'da (yoki halqada) joylashishi Z- (nemis tilidan Zusammen - birgalikda) yoki E- (nemischa Entgegen dan - qarama-qarshi).
Z,E sistemada atom raqami katta bo'lgan o'rinbosarlar katta hisoblanadi. Agar to'yinmagan uglerod atomlari bilan to'g'ridan-to'g'ri bog'langan atomlar bir xil bo'lsa, "ikkinchi qatlam" ga, agar kerak bo'lsa - "uchinchi qatlam" ga va hokazo.
Birinchi proyeksiyada katta guruhlar qo'sh bog'lanishga nisbatan bir-biriga qarama-qarshidir, shuning uchun u E izomeridir. Ikkinchi proektsiyada katta guruhlar qo'sh bog'ning bir tomonida (birgalikda), shuning uchun u Z-izomerdir.
Geometrik izomerlar tabiatda keng tarqalgan. Masalan, tabiiy polimerlar kauchuk (sis-izomer) va gutta-percha (trans-izomer), tabiiy fumarik (trans-butendioik kislota) va sintetik malein (sis-butendioik kislota) kislotalar, yog'lar tarkibida - sis-oleik, linoleik, linolenik kislotalar.
V)Optik izomeriya
Organik birikmalarning molekulalari chiral va axiral bo'lishi mumkin. Xirallik (yunoncha cheir - qo'ldan) molekulaning ko'zgu tasviriga mos kelmasligi.
Xiral moddalar yorug'likning qutblanish tekisligini aylantirishga qodir. Bu hodisa optik faollik deb ataladi va tegishli moddalar optik faol. Optik faol moddalar juft bo'lib uchraydi optik antipodlar- fizik va kimyoviy xossalari normal sharoitda bir xil bo'lgan izomerlar, bir narsa bundan mustasno - qutblanish tekisligining aylanish belgisi: optik antipodlardan biri qutblanish tekisligini o'ngga buradi (+, dekstrorotator izomeri), ikkinchisi - chapga (-, levorotator). Optik antipodlarning konfiguratsiyasi eksperimental ravishda qurilma - polarimetr yordamida aniqlanishi mumkin.
Optik izomerizm molekula tarkibiga kirganda paydo bo'ladi assimetrik uglerod atomi(molekulaning chiralligi uchun boshqa sabablar ham bor). Bu sp 3 dagi uglerod atomiga berilgan nom - gibridlanish va to'rt xil o'rinbosar bilan bog'liq. Asimmetrik atom atrofida o'rinbosarlarning ikkita tetraedral joylashuvi mumkin. Bunday holda, ikkita fazoviy shaklni hech qanday aylanish bilan birlashtirib bo'lmaydi; ulardan biri ikkinchisining oynadagi tasviridir:

Ikkala oyna shakli ham bir juft optik antipod yoki hosil qiladi enantiomerlar .
Optik izomerlar E. Fisher tomonidan proyeksiya formulalari shaklida tasvirlangan. Ular assimetrik uglerod atomiga ega bo'lgan molekulani proyeksiyalash orqali olinadi. Bunday holda, tekislikdagi assimetrik uglerod atomining o'zi nuqta bilan belgilanadi va gorizontal chiziqda chizma tekisligi oldida chiqadigan o'rinbosarlarning belgilari ko'rsatilgan. Vertikal chiziq (chiziq yoki qattiq) chizilgan tekisligidan tashqarida olib tashlangan o'rinbosarlarni ko'rsatadi. Quyida turli yo'llar bilan oldingi rasmdagi chap modelga mos keladigan proyeksiya formulasini yozish:

Proyeksiyada asosiy uglerod zanjiri vertikal ravishda tasvirlangan; asosiy funktsiya, agar u zanjirning oxirida bo'lsa, proektsiyaning yuqori qismida ko'rsatiladi. Masalan, (+) va (-) alanin - CH 3 - * CH (NH 2) - COOH ning stereokimyoviy va proyeksiyaviy formulalari quyidagicha keltirilgan:

Tarkibida bir xil enantiomerlar bo'lgan aralashma rasemat deb ataladi. Rasemat optik faollikka ega emas va enantiomerlardan farq qiladigan fizik xususiyatlari bilan ajralib turadi.
Proyeksiya formulalarini o'zgartirish qoidalari.
1. Formulalarni stereokimyoviy ma’nosini o‘zgartirmagan holda chizma tekisligida 180° ga burish mumkin:

2. Bitta assimetrik atomdagi o‘rinbosarlarning ikkita (yoki har qanday juft son) qayta joylashishi formulaning stereokimyoviy ma’nosini o‘zgartirmaydi:

3. Asimmetrik markazda o'rinbosarlarning bitta (yoki har qanday toq raqam) qayta joylashishi optik antipod formulasiga olib keladi:

4. Chizma tekisligida 90° aylanish formulani antipodga aylantiradi.
5. Har qanday uchta o‘rinbosarning soat yo‘nalishi bo‘yicha yoki teskari yo‘nalishda aylanishi formulaning stereokimyoviy ma’nosini o‘zgartirmaydi:
 6. Chizma tekisligidan proyeksiya formulalarini chiqarish mumkin emas.
6. Chizma tekisligidan proyeksiya formulalarini chiqarish mumkin emas.
Optik faollik molekulalarida kremniy, fosfor, azot va oltingugurt kabi boshqa atomlar chiral markazlar bo'lgan organik birikmalarga ega.
Bir nechta assimetrik uglerod atomlari bo'lgan birikmalar shaklda mavjud diastereomerlar , ya'ni. bir-biri bilan optik antipodlarni tashkil etmaydigan fazoviy izomerlar.
Diastereomerlar bir-biridan nafaqat optik aylanishda, balki boshqa barcha fizik konstantalarda ham farqlanadi: ular turli erish va qaynash nuqtalariga, turli xil eruvchanlikka ega va hokazo.
Fazoviy izomerlar soni Fisher formulasi N=2 n bilan aniqlanadi, bu erda n - assimetrik uglerod atomlari soni. Ba'zi tuzilmalarda qisman simmetriya paydo bo'lishi tufayli stereoizomerlar soni kamayishi mumkin. Optik faol bo'lmagan diastereomerlar deyiladi mezo-shakllar.
Optik izomerlarning nomenklaturasi:
a) D-, L- nomenklaturasi
Izomerning D yoki L seriyasini aniqlash uchun konfiguratsiya (OH guruhining assimetrik uglerod atomidagi holati) glitseraldegid (glitserin kaliti) enantiomerlarining konfiguratsiyasi bilan taqqoslanadi:

L-gliseraldegid D-gliseraldegid
D-, L-nomenklaturasidan foydalanish hozirgi vaqtda optik faol moddalarning uchta sinfi bilan cheklangan: uglevodlar, aminokislotalar va gidroksi kislotalar.
b) R -, S-nomenklaturasi (Kan, Ingold va Prelog nomenklaturasi)
Optik izomerning R (o'ng) yoki S (chap) konfiguratsiyasini aniqlash uchun tetraedrdagi (stereokimyoviy formula) o'rinbosarlarni assimetrik uglerod atomi atrofida shunday joylashtirish kerakki, eng yosh o'rinbosar (odatda vodorod) bo'lsin. "kuzatuvchidan uzoqda" yo'nalishi. Agar qolgan uchta o'rinbosarning kattadan o'rta va kichikga o'tishi soat yo'nalishi bo'yicha sodir bo'lsa, bu R-izomerdir (kattalikning pasayishi R harfining yuqori qismini yozishda qo'lning harakati bilan mos keladi). Agar o'tish soat sohasi farqli ravishda sodir bo'lsa, u S - izomer (pasayib borayotgan ustunlik S harfining yuqori qismini yozishda qo'lning harakati bilan mos keladi).
Optik izomerning R- yoki S-konfiguratsiyasini proyeksiya formulasi yordamida aniqlash uchun o‘rinbosarlarni juft sondagi almashtirishlar bo‘yicha joylashtirish kerak, shunda ularning eng kichigi proyeksiyaning pastki qismida bo‘ladi. Qolgan uchta o'rinbosarning stajining pasayishi soat yo'nalishi bo'yicha R-konfiguratsiyasiga, soat sohasi farqli ravishda esa S-konfiguratsiyasiga to'g'ri keladi.
Optik izomerlar quyidagi usullar bilan olinadi:
a) oqsillar va aminokislotalar, uglevodlar, ko'p gidroksi kislotalar (tartarik, olma, bodom), terpen uglevodorodlari, terpen spirtlari va ketonlar, steroidlar, alkaloidlar va boshqalar kabi optik faol birikmalarni o'z ichiga olgan tabiiy materiallardan izolyatsiya qilish.
b) rasematlarning bo'linishi;
v) assimetrik sintez;
d) optik faol moddalarni biokimyoviy ishlab chiqarish.
BUNI BILADINGMI
Izomeriya hodisasi (yunonchadan - isos - har xil va meros - ulush, qism) 1823 yilda ochilgan. J. Liebig va F. Wöhler ikkita noorganik kislota tuzlari misolida: siyanik H-O-C≡N va portlovchi H-O-N= C.
1830-yilda J.Dyuma izomeriya tushunchasini organik birikmalarga ham kengaytirdi.
1831 yilda organik birikmalar uchun "izomer" atamasi J. Berzelius tomonidan taklif qilingan.
Tabiiy birikmalarning stereoizomerlari turli xil biologik faolliklari (aminokislotalar, uglevodlar, alkaloidlar, gormonlar, feromonlar, tabiiy kelib chiqadigan dorivor moddalar va boshqalar) bilan tavsiflanadi.




